Миопатия эрба: причины, симптомы, лечение
Содержание:
Причины
Было обнаружено, что немалиновую миопатию вызывают десять генов. Заболевание может передаваться по наследству по аутосомно-рецессивному или доминантному признаку. По крайней мере, 50% случаев расстройства происходят по аутосомно-рецессивному наследованию, а остальные наследуются по аутосомно-доминантному типу или являются спорадическими (новые доминантные случаи — первое появление в семье).
Генетические нарушения определяются сочетанием генов определенного признака, которые находятся на хромосомах, полученных от отца и матери.
Рецессивные генетические расстройства возникают, когда человек наследует один и тот же аномальный ген одного и того же признака от каждого родителя. Если человек получает один нормальный ген и один ген заболевания, он будет носителем болезни, но обычно бессимптомным. Риск для двух родителей-носителей передать дефектный ген и, следовательно, иметь больного ребенка, составляет 25 процентов при каждой беременности. Риск иметь ребенка, который будет носителем, как и родители, составляет 50 процентов при каждой беременности. Вероятность того, что ребенок получит нормальные гены от обоих родителей и будет генетически нормальным по этой конкретной особенности, составляет 25 процентов. Риск одинаков для мужчин и женщин.
Доминирующие генетические нарушения возникают, когда для появления болезни необходима только одна копия аномального гена. Аномальный ген может быть унаследован от любого из родителей или может быть результатом новой мутации (изменения гена) у пораженного человека. Риск передачи аномального гена от пораженного родителя потомству составляет 50 процентов при каждой беременности, независимо от пола родившегося ребенка.
У некоторых людей заболевание возникает из-за спонтанной (новой) генетической мутации, которая возникает в яйцеклетке или сперматозоиде. В таких ситуациях расстройство не передается по наследству от родителей.
Установлено, что мутации в гене ACTA1 вызывают примерно 15-25% заболевания. Большинство мутаций ACTA1 являются спонтанным генетическим изменением (новой мутацией) и не передаются по наследству. Тем не менее, некоторые случаи являются результатом аутосомно-доминантного и, реже, аутосомно-рецессивного наследования. Мутации гена ACTA1 могут вызывать тяжелые, промежуточные или типичные врожденные формы немалиновой миопатии.
Мутации в гене NEB были идентифицированы как причина около 50% немалиновой миопатии. Мутации в этом гене могут вызывать любую форму заболевания, но большинство людей с мутацией NEB имеют типичную врожденную форму. Мутации гена NEB наследуются как аутосомно-рецессивный признак.
Мутации в генах TPM2, TPM3, TNNT1, CFL2, KBTBD13, KLHL40, KLHL41 и LMOD3 являются более редкими причинами немалиновой миопатии, и на сегодняшний день сообщается только о меньшем количестве затронутых семей.
Гены, участвующие в расстройстве, содержат инструкции для создания (кодирования) определенных белков, которые играют важную роль в нормальной структуре и функции сократительного аппарата скелетных мышц. Мутации этих генов приводят к дефициту или дисфункции этих белков. Эти белки работают вместе, образуя структуры, известные как тонкие филаменты, которые в основном представляют собой длинные цепи белков. Тонкие волокна находятся в саркомере, основной структурной и функциональной единице поперечно-полосатой мышцы, и они играют роль в формировании и сократительной функции волокон скелетных мышц. Следовательно, если эти белки недостаточны или повреждены, сила мышечного сокращения и в некоторых случаях развитие нормальной мышечной структуры нарушается.
Терапия
Полноценного лечения миопатии на данный момент еще не разработано. Терапия при различных формах патологии разрабатывается в рамках генной инженерии. Специалист изучает симптомы, и лечение миопатического синдрома у детей назначается с учетом их проявления.
В рамках симптоматической терапии показан прием витаминов. Основу лечения составляют витамины группы В и Е. Для улучшения обмена веществ в тканях мышц также назначаются аминокислоты. К ним относится глютаминовая кислота. Также рекомендован гидролизат, получаемый из свиного мозга.
Для нормализации метаболизма показаны аденозинтрифосфат, анаболические стероиды (деканоат нандролона), тиаминпирофосфат. Также при лечении используются неостигмин, галантамин, калиевые и кальциевые препараты. Назначаемые средства принимаются в комбинации. Курс терапии длится от 30 до 45 дней трижды в год.
Обязательно дополнение медикаментозного лечения физиотерапевтическими процедурами. Больной проходит следующие из них:
- лечение ультразвуком;
- электрофорез с использованием неостигмина;
- ионофорез с применением кальция.
Больным также показан легкий массаж. Им подбираются индивидуальные упражнения в рамках лечебной физкультуры. При этом упражнения рекомендуется делать в воде. Также пациентам требуется носить корректирующие корсеты. После консультации с ортопедом подбирается специальная обувь.
Метаболическая миопатия
Метаболическая миопатия, как и большинство других неврологических патологий, сопровождается дефицитом липидных фракций. Зачастую это проявляется резким снижением способностей к выполнению физических упражнений. Наиболее распространенными случаями нарушения липидного обмена являются дефицит фермента КПТ и карнитина. Для синдрома дефицита карнитина свойственно прогрессирование мышечной слабости, поражение глоточных и лицевых мышц, а также мышц конечностей. При недостатке КПТ больной чувствует сильную боль из-за физических нагрузок.
Еще одним проявлением метаболической миопатии считается нарушение обмена глюкозы и гликогена. Если у пациента наблюдается избыточное скопление гликогена, то в состоянии покоя он чувствует себя нормально. В случае дефицита ферментов при повышении активности больные жалуются на мышечную слабость и чрезмерную утомляемость. Если в этом случае не прекратить физическое нагрузки, может произойти мышечная контрактура, что приведет к серьезному повреждению мышечной ткани.
Суть нарушения
Миопатия относится к категории нервно-мышечных заболеваний, при которых в скелетных мышцах возникают дистрофические изменения, и атрофируются отдельные миофибриллы (волокна). Функция анимальной (соматической) нервной системы, регулирующей работу поперечно-полосатой мускулатуры, при этом абсолютно не страдает и полностью сохраняется.
Мышечная миопатия отличается неуклонным прогрессированием и впервые проявляется чаще всего в детском или подростковом возрасте. Подавляющее большинство случаев обусловлено наследственностью, реже встречаются приобретенные формы.
В ходе патанатомических исследований органических нарушений в нервной системе не обнаруживается. Изредка наблюдается уменьшение количества клеток рогов спинного мозга, набухание миелиновой оболочки двигательных нервов, изменения в осевых цилиндрах.
Зато в поперечно-полосатых мышцах отмечаются грубые трансформации: мышцы становятся тоньше, их значительная часть замещается соединительной и жировой тканью. Моторные бляшки, расположенные на мышечном волокне в точке окончания двигательного нерва, утрачивают фибриллярное строение.
Типична неравномерность мышечных волокон: одни из них существенно уменьшены в размерах, другие гипертрофированы, а третьи остаются нормальными. Все они расположены хаотично, и именно этот признак отличает миопатию от «пучковых» поражений при неврогенных амиотрофиях.
Уже на самых ранних стадиях сильно разрастается соединительная ткань, в основном за счет коллагеновых волокон. В дальнейшем мышцы практически полностью замещаются соединительной и/или жировой тканью. Кровеносные сосуды сужаются, их внешняя оболочка также разрастается. В отдельных случаях наблюдается пристеночное тромбообразование.
Причиной дистрофии мышц являются врожденные или приобретенные пороки метаболитов, которые принимают участие в обменных процессах и формировании мышечных волокон. После замещения нормальных миофибрилл жиром и соединительной тканью мышца уже не может сокращаться и выполнять активные движения.
Согласно проведенным экспериментам, у пациентов с разными формами миопатий были выявлены нарушения работы вегетативной нервной системы. Это в полной мере объясняет преимущественное поражение верхних (проксимальных) отделов конечностей, имеющих наиболее богатую вегетативную иннервацию.
Что такое миопатия Дюшенна
Диета
Специально разработанной диеты при врожденных прогрессирующих миопатиях не существует, однако, имеются некоторые рекомендации, соблюдение которых способствует улучшению состояния больного. В основе — сбалансированная диета с высоким содержанием животного белка (диетические сорта мяса, рыба, морепродукты, творог, куриные яйца), снижением животных жиров, и достаточное употребление растительных масел и продуктов из цельного зерна, свежих овощей, фруктов, позволяющих обеспечить физиологические потребности организма в природных антиоксидантах, токоферолах, аскорбиновой кислоте, каротиноидах и других компонентах, повышающих систему антиоксидантной защиты. Кроме основных продуктов в рацион питания рекомендуется включать:
- Продукты, содержащие селен. В ряде исследованиях показано, что в сыворотке крови пациентов с прогрессирующей мышечной дистрофии уровень селена снижен. Селен обладает выраженными антиоксидантными свойствами и оказывает влияние на уровень свободных радикалов/пероксидов липидов. Источниками селена являются морепродукты, чеснок, грибы, зародыши пшеницы и цельные зерна, пивные дрожжи, куриное мясо, бурый рис, красные водоросли, брокколи, лук, лосось.
- Таурин. Аминокислота, необходимая для нормального обмена кальция, натрия, калия и магния. Способен повышать внутриклеточную концентрацию калия и улучшать мембранную проводимость. Содержится в птице, яйцах, рыбе, моллюсках, мясе.
- Кофермент Q10. Является митохондриальным дыхательным кофактором и антиокислителем, обладает мембраностабилизирующим действием. Наибольшее содержание кофермента Q10 обнаружено в печени, мясе, бычьем сердце, сардине, макрели, лососе, арахисе, шпинате.
- Зеленый чай. Исследование на животных показало, что при частом употреблении зеленого чая у лабораторных животных отмечается уменьшение мышечной слабости в конечностях. То есть, зеленый чай (в объеме 5-7 чашек в день) имеет терапевтический потенциал для предотвращения атрофии миоцитов. Исследователи пришли к выводу, что при наследственных дистрофиях мышц целесообразно употребление зеленого чая как антиоксиданта и скавенджера (ловушки) свободных радикалов, способствующего снижению уровня окислительного стресса в скелетной/сердечной мускулатуре.
Для поддержания необходимого уровня минералов в организме рекомендуется включать в рацион питания в виде крутого чая из моно травы или комплекса нескольких трав, которые настаиваются 10–20 минут из корней и 5–10 минут из цветков/листьев и употребляют по 2–3 чашки в день. При прогрессирующей мышечной дистрофии рекомендуются чаи из следующих трав:
- Для минерализации рациона питания — хвощ полевой, крапива двудомная, овес посевной, пырей ползучий.
- При мышечной слабости и миалгии: таволга вязолистная, писцидия ярко-красная.
Воспалительные миопатии
Диагноз полимиозита устанавливают при наличии минимум четырех признаков (со 2-го по 9-й пункт).
При полимиозите в эндомизии и перимизии наблюдаются множественные очаги воспаления, представленные лимфоцитами, макрофагами и гистиоцитами. Имеют место васкулиты различной степени выраженности. Длительно протекающее заболевание характеризуется пролиферацией клеток-сателлитов, атрофией и гипертрофией миоцитов.
В коже выявляются множественные васкулиты всех слоев дермы. В периваскулярных пространствах присутствуют лимфоцитарные инфильтраты в большом количестве. Патология сосудов приводит к умеренным деструктивным процессам в коллагене. В пигментированных участках кожи эпидермис истончен, дерма склерозирована и расширена с минимальной лимфоцитарной инфильтрацией. Следует подчеркнуть, что продуктивные васкулиты не имеют нозологической специфичности этого заболевания.
Лечение патологии
Лечение миопатии – сложный, продолжительный процесс, требующий применения сильнодействующих препаратов. Наиболее распространенный способ терапии патологии легкой степени – применение глюкокортикостероидов, в частности, — преднизолона. Ежедневная дозировка находится в пределах 100 мг.
В тяжелых случаях лечить воспалительную миопатию нужно пульс-терапией, что предполагает прием ударных доз метилпреднизолона. Осложняется лечение миопатии тем, что принимать глюкокортикостероиды в течение длительного времени невозможно из-за побочных эффектов.
Запрещено проводить терапию, если у пациента есть болезни:
- язва;
- гипертония;
- катаракта или глаукома;
- остеопороз.
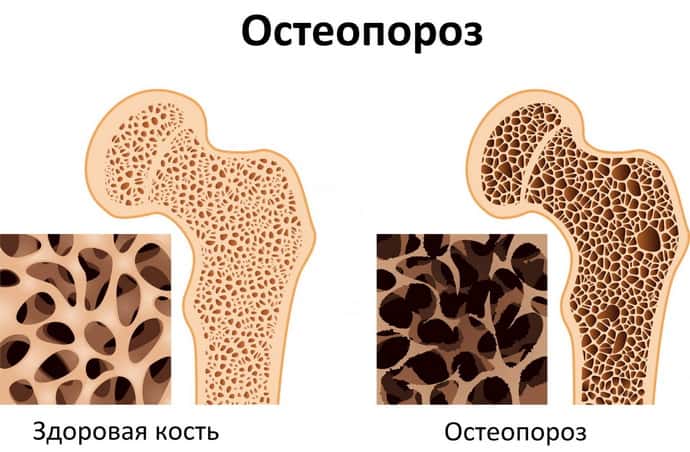
Если в течение 3 месяцев после начала терапии нет улучшений, то пациенту с воспалительной миопатией нельзя продолжать лечение из-за устойчивости к стероидам.
Эффект этих препаратов не такой выраженный, но они подходят для лечения, если возможно применение уменьшенных доз стероидов. Если диагностирована системная патология, назначают плазмоферез для сокращения антител в плазме крови.
Прогноз при воспалительной миопатии положительный, если терапия начата вовремя. Симптомы болезни поддаются коррекции, но могут возникнуть трудности при заболеваниях сердца. Примерно треть пациентов восстанавливается почти полностью, у 30% сохраняются рецидивы, а у оставшегося количества человек болезнь приобретает хронический характер. При этом некротизирующие формы патологии сложно поддаются лечению.
Что такое миопатический синдром
Миопатический синдром — это поражение мышц человека. Для данной патологии свойственно хроническое течение с постоянным прогрессированием симптомов. При миопатическом синдроме происходит сбой в обмене веществ и самой структуре ткани мышц.
Итогом становится серьезная ограниченность в движениях человека, а также уменьшение силы в его мышцах.
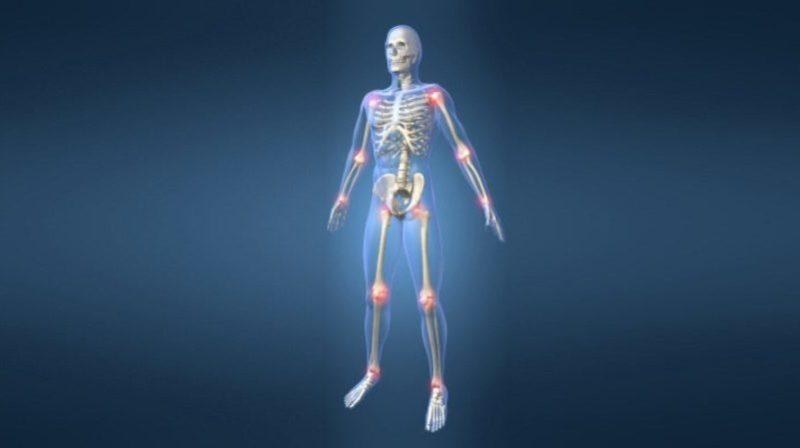
Под миопатическим синдромом подразумеваются различные патологии, связанные с поражением мышц. Они характеризуются дистрофическими явлениями в тканях. При этом чаще поражается скелетная мускулатура.
При синдроме возникает выборочная атрофия, затрагивающая некоторые волокна. Сама анимальная нервная система продолжает сохранять свою функциональность.
Симптомы
Характерным признаком всех миотоний является симптом «кулака». Характеризуется он тем, что, сжав кулак, больной не может его быстро разжать. Для этого ему потребуется приложить определенные усилия. При последующих сжатиях кулак разжимается легче. Скованность возрастает только при миотонии Эйленберга.
Общие затруднения при всех формах заболевания возникают при попытке открыть рот, встать со стула, быстро открыть глаза, которые до того были закрыты.
Тяжесть проявления симптомов позволяет выделить легкую, среднетяжелую и тяжелую форму заболеваний. Последняя характерна преимущественно для врожденных заболеваний.
Миотония Томпсона и Беккера
В начале развития заболевания возникают болезненные спазмы мышц голени. В дальнейшем поражаются мышцы лица, глотки, языка. Симптомы могут уменьшаться с возрастом. У некоторых они и вовсе исчезают. На смену им приходят парезы и атрофия мышечных волокон головы, шеи. При уменьшении жевательных мышц происходит западение щек. Атрофия шейных волокон ведет к запрокидыванию головы.
Позже затрагиваются мышцы конечностей. Возрастает их слабость, уменьшается сила.
Страдает сердечно-сосудистая система. Возникают эпизоды аритмии, брадикардии, снижения артериального давления. Выпадают волосы, зубы, кожные покровы становятся очень тонкими.
Дистрофическая миотония Россолимо-Штейнерта-Куршмана
Первые симптомы проявляются в возрасте 15-20 лет, иногда – в 35. Появляются спазмы мышц, двигательная возбудимость, с развитием болезни эти признаки угасают, чего нельзя сказать о комплексе миопатических симптомов. Развивается атрофия мышечной ткани лица, шеи, кистей рук, снижаются сухожильные рефлексы. Реже поражаются мышцы ног и висков. Постепенно нарастает слабость, больные жалуются на быструю утомляемость.
Атрофия мышц гортани ведет к нарушению глотания, осиплости или потере голоса. У мужчин развивается импотенция, у женщин нарушается менструальный цикл. Часто возникают нарушения сердечно-сосудистой деятельности, ведущие к аритмии, брадикардии.
У многих больных появляется катаракта. Во сне возможны приступы апноэ.
Болезнь Лейдена-Томсена-Беккера
Основной признак – невозможность расслабить мышцы после их напряжения, возникают спазмы. Они поражают человека, когда он закрывает глаза, смыкает челюсти или сжимает руки в кулак. При этом обратное движение в течение долгого времени сделать не получается.
По внешнему виду больные похожи на спортсменов. На ощупь мышцы твердые, плотные, однако силы в них нет.
Врожденная дистрофическая миотония
Патология характеризуется нарушением у ребенка частоты сердечного ритма, повышенной сонливостью, усилением скованности в холод, эндокринными патологиями.
Парамиотония Эйденбурга
Расслабление мышц затрудняется при холодной температуре окружающего воздуха или местного воздействия. Так, при употреблении сильно холодных продуктов спазм охватывает глотку и язык. Снимается он после согревания.
При общем переохлаждении возникает так называемый «холодный паралич».
Причины врожденной миопатии
Этиология заболевания до конца не изучена. Врожденные миопатии формируются еще в утробе матери и проявляются в неонатальном периоде.
В первые месяцы жизни ребенка отмечается вялость, пассивность, слабое сосание, быстрая утомляемость. После 6 месяцев – затруднения при попытках сидеть, встать на ножки. Малыш отстает от сверстников в физическом развитии. В отдельных случаях обездвиженность наблюдается уже на первом году.
При некоторых видах присоединяются патологии других систем организма:
- психической сферы – задержка психического развития, умственная отсталость;
- сердечно — сосудистой и дыхательной систем – сердечная и дыхательная недостаточность, представляющие угрозу для жизни;
- костной системы – специфическое строение лица (высокое небо), деформации позвоночника (сколиоз, кифоз), врожденный вывих бедра.
Виды миопатии и ее симптомы
Разновидности заболевания отличаются по типу наследования, локализации измененных генов и виду дефектных белков. Различают 2 патологические группы:
- мышечные дистрофии – дисфункция мышечных волокон, обусловленная дефектом белков, находящихся в их составе;
- структурные миопатии – изменение структуры мышц, вызванное нарушением синтеза белков в период формирования эмбриона.
Классификация врожденных миопатий представлена в таблице.
|
Виды врожденных миопатий |
||
|
Врожденные мышечные дистрофии |
Врожденные структурные дистрофии |
|
|
Мерозин — негативные |
Мерозин — позитивные |
Болезнь центрального стержня |
|
На первый план выходят костные изменения |
Немалиновая |
|
|
С диспропорцией типов мышечных волокон |
||
|
К общим симптомам присоединяется недоразвитие мозга |
Со множественными центральными стержнями |
|
|
Миотубулярная |
||
|
Центронуклеарная |
Остановимся на некоторых формах подробнее.
Болезнь центрального стержня
На первом годужизни ребенок отстает в физическом развитии, наблюдается сниженный тонус мышц. Эти симптомы относят к другим патологиям раннего детского возраста, поэтому диагноз ставят при выраженной клинической картине у более старших детей, когда налицо мышечная слабость, ограничения в движениях и костные деформации. Характерна хрупкость фигуры, маленький рост. Больные могут сохранять некоторую двигательную способность. При этой форме возможно развитие злокачественной гипертермии.
Немалиновая
Тяжелая форма диагностируется во внутриутробном возрасте и после родов грубыми скелетными деформациями, гипотонией мимической мускулатуры и дыхательной недостаточностью, нередко приводящей к смерти.
Легкая форма выявляется после трех лет, даже у подростков, без вышеупомянутых симптомов. В одних случаях болезнь может медленно прогрессировать, в других – вялотекущая.
Выделяют разновидность этой формы, включающей кардиомиопатию, офтальмоплегию, патологию позвоночника.
С диспропорцией типов мышечных волокон
Отмечается генерализованная гипотония, деформации скелета.
Со множественными центральными стержнями
У грудничков наблюдается выраженная мышечная слабость в конечностях. У более старших детей гипотония носит генерализованный характер.
Миотубулярная
Встречается у детей обоего пола, симптомы выражены в легкой степени. Выделена Х-сцепленная разновидность, которая бывает только у мальчиков. Протекает она тяжело, с выраженной атрофией, нарушением глотания и дыхания.
Центронуклеарная
Наиболее распространена разновидность с ранним дебютом, с самого рождения. Характеризуется триадой: дыхательной недостаточностью, гипотонией и нарушениями скелета. Могут присоединяться умственная отсталость и патология глаз. Течение неблагоприятное, ведет к полной инвалидизации.
Подробно о формах и видах миопатии.
Диагностика миопатии
Диагностика врожденных миопатий опирается на биопсию мышечной ткани. При разных видах биопсия показывает:
- отсутствие в мышечных волокнах окислительных ферментов (болезнь центрального стержня);
- палочкоподобные или нитевидные немалиновые тельца (немалиновая миопия);
- множественные мышечные волокна I типа уменьшенного размера в то время, как волокна II типа увеличены или нормального размера (миопия с диспропорцией типов мышечных волокн);
- клетки без митохондрий, с нарушением структуры миофибрилл (миопия со множественными центральными стержнями);
- ядра в мышечных волокнах расположены центрально, что идентично состоянию миофибрилл у 8-10 недельного плода и подтверждает мышечное недоразвитие (миотубулярная).
Остальные методы обследования служат дополнением к постановке диагноза:
- электромиографическое исследование (показывает снижение вольтажа кривой ЭМГ),
- биохимическое исследование (обнаруживает повышение уровня альдолазы и креатинкиназы),
- осмотр врача.
Формы и виды
Рассматриваемую патологию принято классифицировать в соответствии с зоной поражения, например, существует конечностно-поясная, этиологическим фактором или по тому, что более поражено – ферменты или белки.
Согласно иной классификации миопатии бывают:
– врождёнными, которые, в свой черёд, подразделяются на немалиновую, патологию центрального стержня, миотубулярную, диспропорцию миофибрилл, мерозин-негативную;
– наследственными (ювенильная, псевдогипертрофическая, плече-лопаточно-лицевая, окулофарингеальная, дистальная и скапулоперонеальная формы);
– воспалительными (вирусная, идиопатическая, инфекционная, паразитарная формы);
– метаболическими (обусловленные сбоем липидного обмена, метаболизма пуринов или гликогена, митохондриальная формы);
– мембранными (Болезнь Беккера и Миотония Томпсона);
– токсическими (вследствие алкоголизма, интоксикации, наркомании, по причине вредностей, связанных с профессией).
Ювенильная форма дебютирует в двадцати-, тридцатилетнем возрасте. Начинается она поражением мускул бёдер, тазовых мышц, распространяясь постепенно на остальной организм. Лицевые мускулы не поражаются. Чем ранее дебютировал недуг, тем хуже прогноз.
Больные миопатией молодые люди довольно быстро приобретают обездвиженность, тогда как у зрелых лиц процесс длится годами.
Псевдогипертрофической миопатии подвержены мальчики трёхлетнего возраста, реже старше. Дебютирует с мышечного аппарата конечностей и таза. Ей сопутствует искривление позвоночника. Дети отстают в интеллектуальном развитии и физическом созревании. Также поражаются мускулы миокарда и дыхательного аппарата, рано образуются контрактуры суставов. Часто описываемая форма недуга заканчивается летально.
Возрастному периоду 10-20 лет характерна плече-лопаточно-лицевая форма патологии. Дебютирует она, в отличие от вышеприведённых разновидностей, поражением мимических мускул, постепенно переходящие на грудные мышцы и мускулы верхних конечностей. При этом отсутствует поражение тазовых мышц. Характеризуется вялотекущим течением на фоне сохранности работоспособности.
При скапулоперонеальной разновидности наблюдается спад чувствительности и атрофия мускул конечностей.
Окулофарингеальная миопатия чаще возникает у более взрослых лиц. Проявляется сочетанием атрофии языкоглоточных и глазодвигательных мускул. Дебютирует двусторонним птозом (опущение века), позже возникает нарушение глотания.
Дистальная форма вначале затрагивает стопы и кисти, позже распространяется на голени и предплечья. Течение замедленное.
Врождённые формы описываемой патологии детерминированы трансформациями генов, отвечающих за белковый синтез, происходящий в ткани мускул. Проявляются нарастающей слабостью мышц, к которой нередко присоединяются миокардиальная и дыхательная недостаточности, угрожающие жизни. При отсутствии осложнений, данная форма недуга протекает без прогрессирования, вяло. Дифференцируются они по разновидности дефектных белков, типу наследования и локализации измененных генов.
Мерозин-негативная или дефицитная форма патологии зарождается вследствие генной мутации, приводящей к недостаточности продукции белка мерозина. Отмечается сочетание дыхательной недостаточности с атрофией конечностей.
Воспалительные формы описываемого отклонения развиваются на фоне инфекционно-вирусных процессов. Если определить возбудитель миопатии не удаётся, то такая форма патологии именуется идиопатической.
Метаболические разновидности формируются как следствие клеточных нарушений и обменных сбоев.
Мембранные миопатии развиваются при дефектах мембран волокон мышц и сопровождаются миотонией. Характерен ранний дебют недуга. У ребёнка отмечаются дефекты речи, нарушение глотания. Он не в состоянии совершать быстрые движения. Приобретённым формам всегда присуще более благоприятное течение.
Подготовка к зиме
Для обеспечения комфортной зимовки в первые несколько лет сосну необходимо укрывать лапником. По достижению 2-х лет она становится полностью устойчивой к резким температурным перепадам, спокойно переносит сильные морозы и порывы ветра.
Убирать укрывной материал следует в тот момент, когда на улице установились стабильные показатели температур и минует угроза заморозков. Для запуска вегетационных процессов рекомендуется поливать молодую сосенку теплой талой водой.